 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
某原电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法正确的是()
A.硝酸可能为电解质溶液
B.锌可能为原电池正极
C.铁的质量不变
D.铜可能为原电池正极
 答案
答案
D、铜可能为原电池正极
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.硝酸可能为电解质溶液
B.锌可能为原电池正极
C.铁的质量不变
D.铜可能为原电池正极
 答案
答案
D、铜可能为原电池正极
 更多“某原电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法正确的是()”相关的问题
更多“某原电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法正确的是()”相关的问题
第1题
固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验: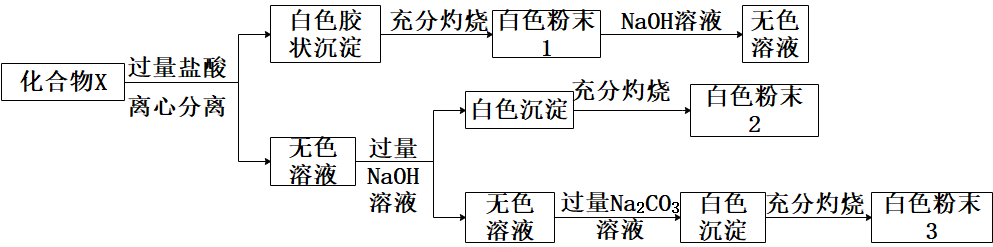 ①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是()。
(2)化合物X与足量盐酸反应离子方程式()。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式()。
第2题
高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表: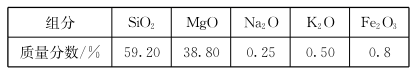 通过下图流程可由蛇纹石制备较纯净的二氧化硅。
通过下图流程可由蛇纹石制备较纯净的二氧化硅。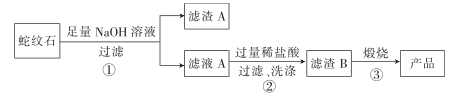 (1)蛇纹石中涉及的可溶性金属氧化物有()(写化学式)。
(1)蛇纹石中涉及的可溶性金属氧化物有()(写化学式)。
(2)步骤①中涉及SiO2 反应的离子方程式为()。
(3)滤渣 A的成分有()(填化学式)。
(4)步骤②中洗涤沉淀的方法是()。
(5)步骤③反应的化学方程式为();实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、()和()。
第3题
粉煤灰是一种火山灰质材料,来源于煤中的无机组成,从粉煤灰中能够获得Al2O3,已知某火力发电厂的粉煤灰中的化学成分如下表。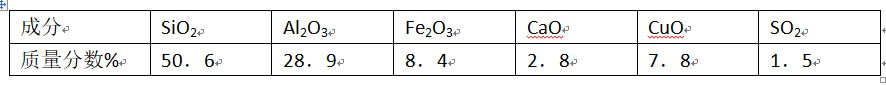 问题一、上述氧化物中能与水反应的是()。
问题一、上述氧化物中能与水反应的是()。
问题二、从粉煤灰中提取Al¬2O3的一种工艺流程如下:
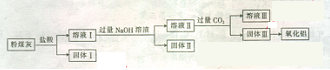
①体I中含有的主要物质的化学式为()。
②溶液Ⅱ中通人过量的CO2,发生反应的离子方程式为()。
问题三、氧化铝和焦炭的混合物与氮气在高温下反应,可制得新型非金属材料A1N与一种中学常见气体x。已知每转移3mol-,就有1.5mol化合物X生成,此反应的化学方程式为()。
第4题
高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH 主要的生产流程如下: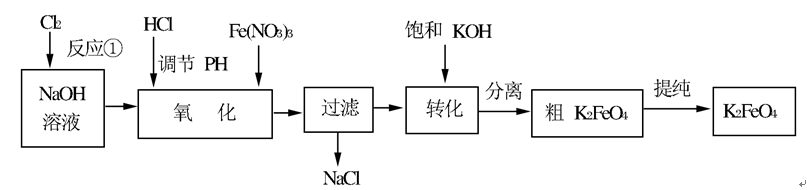 问题一、写出反应①的离子方程式()。
问题一、写出反应①的离子方程式()。
问题二、流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)()Ksp(Na2FeO4)〔填“>”或“<”或“=”〕。
问题三、反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最正确时,NaClO浓度对K2FeO4生成率的影响
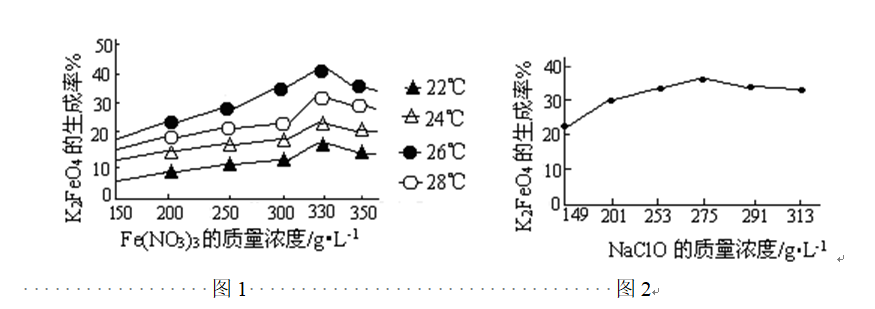
①工业生产中最正确温度为()℃,此时Fe(NO3)3与NaClO两种溶液最正确质量浓度之比为()。
②假设NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:()。假设Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化复原反应生成K3FeO4,此反应的离子方程式:()。
问题四、K2FeO4在水溶液中易水解:
4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液()(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液()(填序号)。
AH2O
BCH3COONa、异丙醇
CNH4Cl、异丙醇
DFe(NO3)3、异丙醇
第5题
工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示: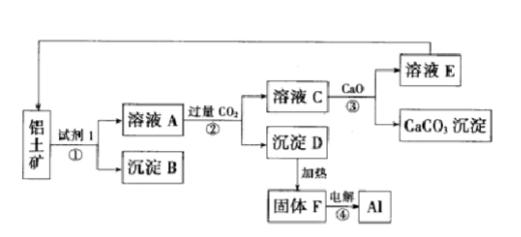 请回答:
请回答:
(1)试剂Ι为()(填化学式),①-④转化中属于氧化还原反应的是()(填序号);
(2)沉淀B的化学式为(),写出该物质发生铝热反应的化学方程式();
(3)电解F,当转移0.6mol,电子时,可制得铝()g;
(4)沉淀D是药物“胃舒平”的主要成分,可用于治疗胃酸(稀盐酸)过多,写出该反应的离子方程式();
(5)②中发生反应的离子方程式为()。
第6题
“铝热反应”的化学方程式为:2Al+Fe2O3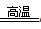 Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:

(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是:()。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是(),当观察到现象时,说明熔融物中含有金属铝,反应的离子方程式为()。
(3)实验室溶解该熔融物,最好选用下列试剂中的()(填序号)。
A.浓硫酸B.稀硫酸C.稀硝酸D.氢氧化钠溶液
第7题
第8题
A.若有0.1 mol 氧化产物生成,则转移0.5 mol 电子
B.铋酸钠难溶于水
C.该反应可以用于鉴定Mn2+离子
D.该反应可以用浓盐酸酸化
第9题
从含镍废催化剂中可回收镍,其流程如下: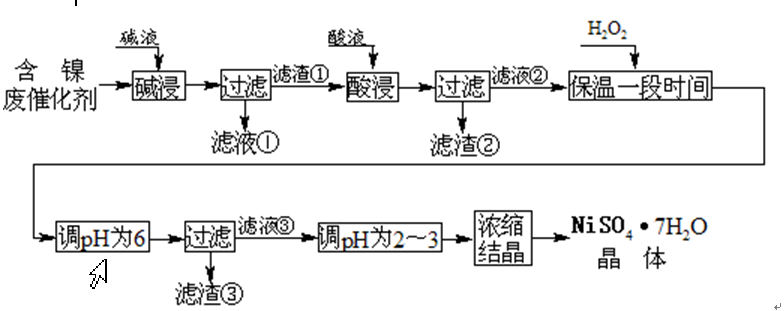 某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。部分阳离子以氢氧化物形式完全沉淀时的pH如下
某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。部分阳离子以氢氧化物形式完全沉淀时的pH如下
问题一、碱浸“的目的是除去()。
问题二、“酸浸”时所加入的酸是()(填化学式)。酸浸后,滤液②中可能含有的金属离子是()。
问题三、“调pH为2~3”的目的是()。
问题四、产品晶体中有时会混有少量绿矾(FeSO4•7H2O),可能是由于生产过程中()导致Fe2+未被完全氧化造成的。
问题五、NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是()
第10题
铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下: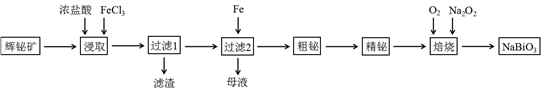 已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有()(任写一条);过滤1的滤渣中的某种主要成分可溶于一种弱酸,写出该反应的化学方程式()。
(2)浸取时加入过量浓盐酸的目的是()。
(3)写出焙烧时生成铋酸钠的化学方程式()。
(4)用H2Dz(双硫腙,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
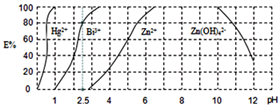 ①当n(Bi3+):n[Bi(HDz)3]=1:4时,废水的pH=()。
①当n(Bi3+):n[Bi(HDz)3]=1:4时,废水的pH=()。
②向萃取后的CCl4中加入足量的NaOH溶液可将Bi(HDz)3中铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为()。
(5)取焙烧得到的NaBiO3样品加入稀硫酸和MnSO4溶液使其完全溶解。已知NaBiO3被还原为Bi3+,Mn2+被氧化成MnO4-,试写出该反应的离子方程式:()。
第11题
A.氧化产物是SO42-
B.氧化剂与还原剂的物质的量之比是1:3
C.r2O72-表现了氧化性
D.还原1molCr2O72−,电子转移3 mol